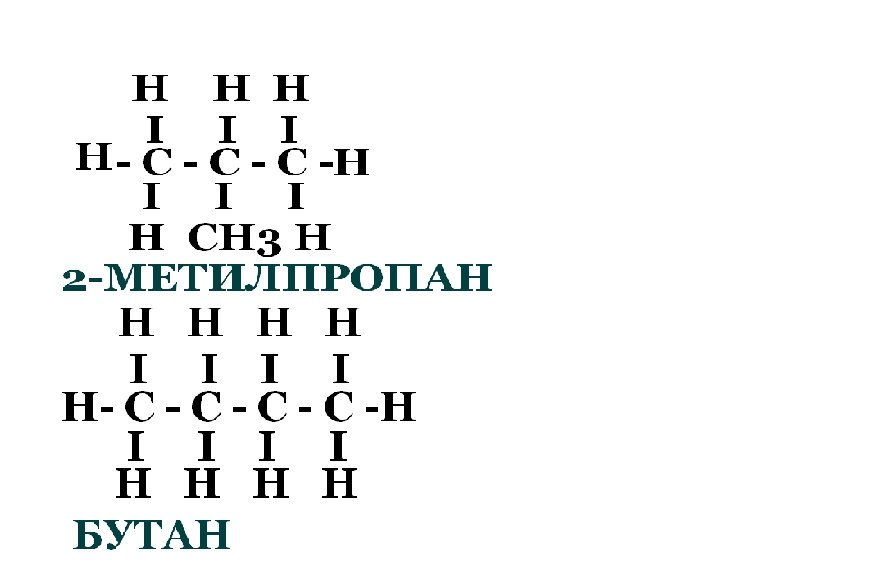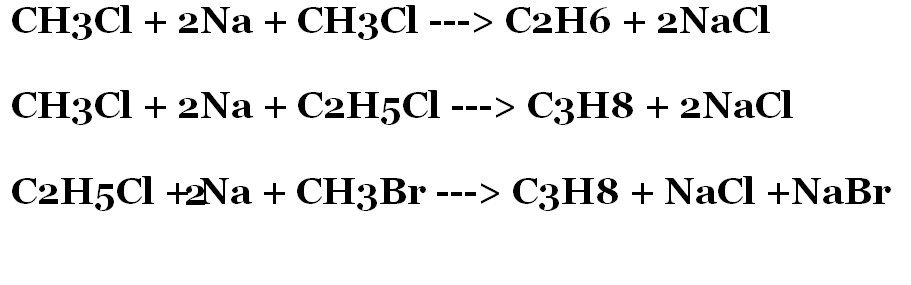Понятия
Електролитна дисоциация
Това е процеса на разпадане на молекулите на дадено вещество до йони с противоположни знаци. Те биват силни и слаби според това дали се разпадат изцяло или частично на йони.
Силен електролит е HCl \HCl ---> H+ + Cl-
Слаб електролит е HCN \ HCN ---> H+ + CN-
Това са обратими процеси, при веществата с йонно кристален строеж се наблюдава кристализация а за тези с полярни молекули моларизация.
Силен електролит е HCl \HCl ---> H+ + Cl-
Слаб електролит е HCN \ HCN ---> H+ + CN-
Това са обратими процеси, при веществата с йонно кристален строеж се наблюдава кристализация а за тези с полярни молекули моларизация.
Валентност
Валентността е свойството на атомите на един химичен елемент да се свързва с точно определен брой атоми от друг химичен елемент.
Валентности:\най-характерни\
1А група - 1постоянна
2А група - 2постоянна
3А група - 3постоянна
4А група - 4 и 2променливи
5А група - 5 и 3променливи
6А група - 6 и 2променливи
7А група - 7 и 1променливи
Валентности:\най-характерни\
1А група - 1постоянна
2А група - 2постоянна
3А група - 3постоянна
4А група - 4 и 2променливи
5А група - 5 и 3променливи
6А група - 6 и 2променливи
7А група - 7 и 1променливи
Степен на окисление
Степента на окисление е зарядът който елементите приемат при химичните реакции. Тя бива положителна и отрицателна.
Определянето на степента на окисление в йонните вещества е равна на заряда на елементите а при останалите се приема че са йонни и се определя по същия начин.
Характерни степени на окисление.
1А група - +1
2А група - +2
3А група - +3
4А група - -4,+2,+4
5А група - -3,+3,+5
6А група - -2,+4,+6
7А група - -1,+1 до +7
Определянето на степента на окисление в йонните вещества е равна на заряда на елементите а при останалите се приема че са йонни и се определя по същия начин.
Характерни степени на окисление.
1А група - +1
2А група - +2
3А група - +3
4А група - -4,+2,+4
5А група - -3,+3,+5
6А група - -2,+4,+6
7А група - -1,+1 до +7
Електроотрицателност
Силата с която даден елемент притегля общата ел. двойка към себе си.
Ковалентна химична връзка
Химична връзка осъществяваща се посредством общи електронни двойки. Бива неполярна и полярна
- Неполярна е химичната връзка при двуатомните молекули на простите вещества O2,Cl2,N2...При тях общата електронна двойка принадлежи в еднаква степен и на двата атома заради еднаквите стойности на електроотрицателностите им.
- Полярна е химичната връзка при съединенията чиито елементи имат разлика на електроотрицателностите си <1.69. При тях атома на по-електроотрицателния елемент изтегля общата електронна двойка към себе си.
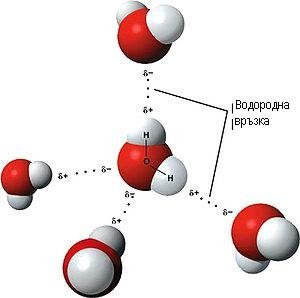
Водородна връзка
Водородната връзка е слаба междумолекулна връзка осъществяваща се между атом водород от един дипол със силно електроотрицателен атом\N,O,F\от друг дипол.
Такава е връзката между молекулите на водата.
Такава е връзката между молекулите на водата.
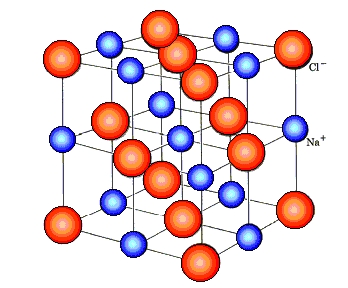
Йонна химична връзка
Съединенията чиито елементи имат разлика >1.69 в електроотрицателностите си имат йонна химична връзка. Тя се изгражда посредством преход на електрони. В йонната решетка на веществото се намират положителни\катийони\ метални йони, и отрицателни\анийони\ киселинни йони.
Йонната химична връзка се осъществява само между елементи с метален и неметален химичен характер.
Такава е врcзката при съединението NaCl
Йонната химична връзка се осъществява само между елементи с метален и неметален химичен характер.
Такава е врcзката при съединението NaCl
Основно и възбудено състояние на атомите
При обикновени условия атомите са в основно състояние. Имат точно определен брой електрони оформени в ел. двойки и свободни. Когато обаче те биват облъчени с енергия както и при хим. реакции те преминават във възбудено състояние. Тогава електронните двойки се разкъсват и атома придобива друга структура, различна от предходната. При нея ел. двойки оформят свободни електрони с който атома влиза в химични съединения.
При разкъсването на ел. двойки електроните от една АО - атомна орбитала преминават на дурга.
Прехода на електрони става в рамките на един ел. слой.
Броят възбудени състояния на даден елемент е равен на броя на ел. двойки в основно състояние.
При разкъсването на ел. двойки електроните от една АО - атомна орбитала преминават на дурга.
Прехода на електрони става в рамките на един ел. слой.
Броят възбудени състояния на даден елемент е равен на броя на ел. двойки в основно състояние.
Изомерия
Изомерия: свойството на някои органични съединения да имат еднакъв качествен и количествен състав, но различни строеж и свойства.
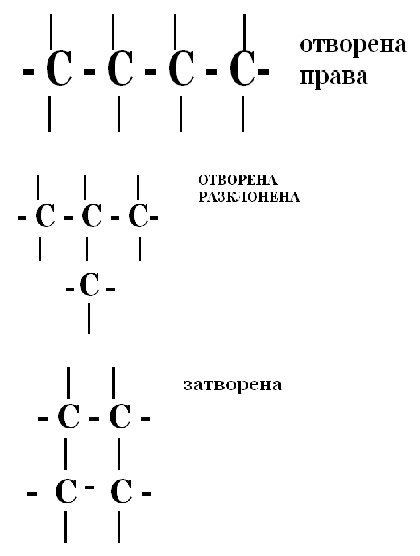
Видове въглеродни вериги
Биват.
ОТВОРЕНИ - ациклични
= прави
= разклонени
ЗАТВОРЕНИ - циклични
ОТВОРЕНИ - ациклични
= прави
= разклонени
ЗАТВОРЕНИ - циклични
Метод на Вюрц
Синтезата на Вюрц се използва за получаване на алкани. Осъществява се при реакцията на халогенопроизводни на алканите с метала натрий.
Крекинг процес
Крекинг(разкъсване) процеса бива няколко вида:
-термичен: при него се наблюдават разкъсване на връзките С-С, С-Н. Извършва се при температури 480-600 градуса С
-каталитичен\изомеризация\: при този процес настъпват промени в строежа на органичното съединения. Осъществява се при температура 450-500 градуса С и катализатор AlCl3.
-термичен: при него се наблюдават разкъсване на връзките С-С, С-Н. Извършва се при температури 480-600 градуса С
-каталитичен\изомеризация\: при този процес настъпват промени в строежа на органичното съединения. Осъществява се при температура 450-500 градуса С и катализатор AlCl3.
Структурна теория
Основни предпоставки за създаването, и основни положения.
- откриване на вещества с еднакъв качествен и количествен състав, на различни свойства\изомери\
-откриване свойството на въглеродния атом:
= че в органичните съединения той е четири валентен
= има способността да образува въглеродни вериги
- утвърждаване на атомно-молекулната теория
- откриване на понятието ВАЛЕНТНОСТ
ОСНОВНИ ПОЛОЖЕНИЕ:
1 - Атомите в молекулата взаимно си влияят.
2 - Атомите в молекулата са подредени по строго определени правила, съгласно тяхната валентност.
3 - Свойствата на веществата не се определя само от техния количествен и качествен състав, а и от строжа на молекулата му
- откриване на вещества с еднакъв качествен и количествен състав, на различни свойства\изомери\
-откриване свойството на въглеродния атом:
= че в органичните съединения той е четири валентен
= има способността да образува въглеродни вериги
- утвърждаване на атомно-молекулната теория
- откриване на понятието ВАЛЕНТНОСТ
ОСНОВНИ ПОЛОЖЕНИЕ:
1 - Атомите в молекулата взаимно си влияят.
2 - Атомите в молекулата са подредени по строго определени правила, съгласно тяхната валентност.
3 - Свойствата на веществата не се определя само от техния количествен и качествен състав, а и от строжа на молекулата му
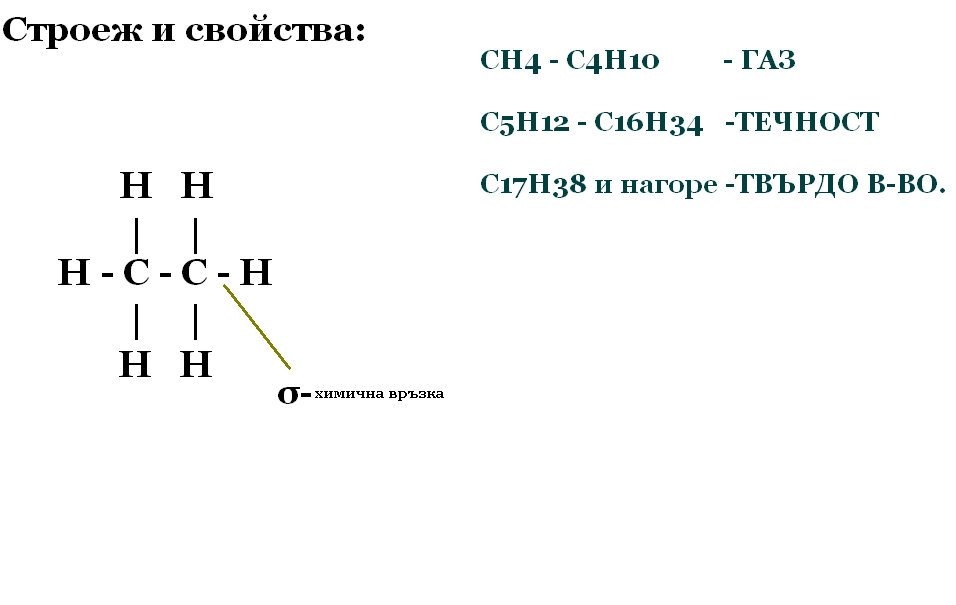
Алкани
Хомоложен ред:
СН4 - метан
С2Н6 - етан
С3Н8 - пропан
С4Н10 - бутан
С5Н12 - пентан
С6Н14 - хексан
С7Н16 - хептан
С8Н18 - октан
С9Н20 - нонан
С10Н22 - декан
. .
. .
. .
СnH2n+2 Алкан
СН4 - метан
С2Н6 - етан
С3Н8 - пропан
С4Н10 - бутан
С5Н12 - пентан
С6Н14 - хексан
С7Н16 - хептан
С8Н18 - октан
С9Н20 - нонан
С10Н22 - декан
. .
. .
. .
СnH2n+2 Алкан
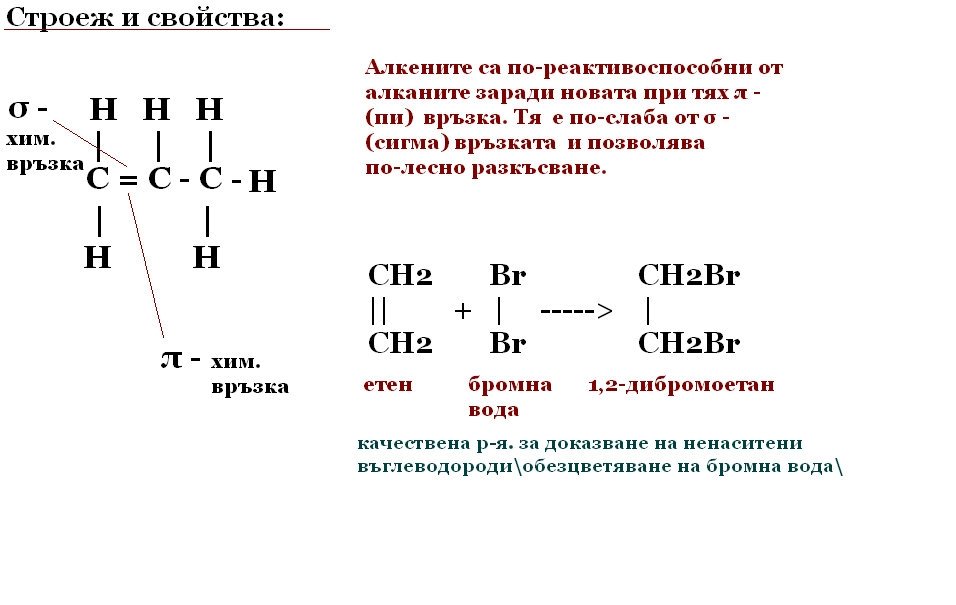
Алкени
Хомоложен ред:
С2Н4 - етен
С3Н6 - пропен
С4Н8 - бутен
С5Н10 - пентен
С6Н12 - хексен
С7Н14 - хептен
С8Н16 - октен
С9Н18 - нонен
С10Н20 - декен
. .
. .
. .
CnH2n Алкен
С2Н4 - етен
С3Н6 - пропен
С4Н8 - бутен
С5Н10 - пентен
С6Н12 - хексен
С7Н14 - хептен
С8Н16 - октен
С9Н18 - нонен
С10Н20 - декен
. .
. .
. .
CnH2n Алкен